發(fā)布時(shí)間:2025-12-04
2025年12月3日,Nature期刊在線發(fā)表了題為《Modeling late gastrulation in stem-cell derived monkey embryo models》的研究論文,該研究由中國(guó)科學(xué)院腦科學(xué)與智能技術(shù)卓越創(chuàng)新中心/上海腦科學(xué)與類腦研究中心劉真研究員聯(lián)合腦智卓越中心孫強(qiáng)研究員、西班牙龐培法布拉大學(xué)Alfonso Martinez-Arias教授和西北農(nóng)林科技大學(xué)王小龍教授合作完成。該研究首次利用干細(xì)胞類胚胎模型,實(shí)現(xiàn)了體外模擬靈長(zhǎng)類晚期原腸運(yùn)動(dòng)發(fā)育過(guò)程,并重現(xiàn)原腸運(yùn)動(dòng)階段的關(guān)鍵發(fā)育事件,為深入理解靈長(zhǎng)類早期胚胎發(fā)育機(jī)制,及發(fā)育異常引起的早發(fā)流產(chǎn)和出生缺陷提供了強(qiáng)大的創(chuàng)新研究范式。
著名的發(fā)育生物學(xué)家劉易斯?沃伯特(Lewis Wolpert)曾指出,人一生中最重要的時(shí)刻不是結(jié)婚、出生或死亡,而是原腸胚的形成。生命最初的“形態(tài)構(gòu)建”——原腸運(yùn)動(dòng),是胚胎發(fā)育中最關(guān)鍵也最神秘的階段之一。在此期間,著床后的囊胚細(xì)胞團(tuán)經(jīng)歷劇烈的細(xì)胞命運(yùn)分化、位置遷移與形態(tài)發(fā)生,形成內(nèi)、中、外三個(gè)胚層,從而奠定胎兒所有組織器官發(fā)育分化的基礎(chǔ)。人類孕育過(guò)程中多數(shù)早期流產(chǎn)與嚴(yán)重出生缺陷源于此階段的異常。然而,由于該階段體內(nèi)胚胎獲取困難、體外胚胎培養(yǎng)的技術(shù)瓶頸以及嚴(yán)格的“14天”倫理限制,導(dǎo)致領(lǐng)域內(nèi)對(duì)于靈長(zhǎng)類原腸運(yùn)動(dòng)這一“黑匣子”的發(fā)生規(guī)律及其調(diào)控機(jī)制研究尚處于起步階段。
類胚胎模型,是指近年來(lái)利用多能干細(xì)胞在體外進(jìn)行誘導(dǎo)和組裝而獲得的一類可以高度模擬正常胚胎形態(tài)發(fā)生、譜系組成和基因表達(dá)特征的胚胎結(jié)構(gòu)。相較于利用正常胚胎開(kāi)展研究,類胚胎模型具有方便獲取、易于基因操作、倫理爭(zhēng)議少等優(yōu)勢(shì),這為深入理解和研究靈長(zhǎng)類著床后原腸運(yùn)動(dòng)提供了重要契機(jī)。目前小鼠干細(xì)胞來(lái)源的類胚胎已經(jīng)能在體外培養(yǎng)發(fā)育至早期器官發(fā)生階段。盡管全世界各地多個(gè)研究團(tuán)隊(duì)嘗試?yán)萌硕嗄芨杉?xì)胞開(kāi)展類似研究,但尚未有研究報(bào)道利用人干細(xì)胞類胚胎模型實(shí)現(xiàn)原腸運(yùn)動(dòng)的完整模擬。已有的研究表明,干細(xì)胞多向發(fā)育潛能的高效維持和穩(wěn)定培養(yǎng)是類胚胎模型誘導(dǎo)的關(guān)鍵。劉真研究員專注于靈長(zhǎng)類胚胎發(fā)育、干細(xì)胞和模型構(gòu)建研究。2023年,劉真研究團(tuán)隊(duì)針對(duì)靈長(zhǎng)類多能干細(xì)胞發(fā)育潛能展開(kāi)系統(tǒng)研究,與合作者首次獲得高比例胚胎干細(xì)胞來(lái)源的嵌合體猴(Cell, 2023)。在此基礎(chǔ)之上,劉真研究團(tuán)隊(duì)與合作者成功利用猴胚胎干細(xì)胞誘導(dǎo)獲得了猴“類囊胚”結(jié)構(gòu),并證明獲得的類囊胚結(jié)構(gòu)具有體外發(fā)育至早期原腸胚階段(Day 17)的發(fā)育潛能(Cell Stem Cell,2023),但當(dāng)時(shí)的研究中類囊胚體外培養(yǎng)發(fā)育效率較低,未能真正突破原腸運(yùn)動(dòng)階段。
本研究中,研究團(tuán)隊(duì)首次利用干細(xì)胞類胚胎模型,完整模擬了靈長(zhǎng)類晚期原腸運(yùn)動(dòng)發(fā)育過(guò)程,并體外重現(xiàn)原腸運(yùn)動(dòng)階段的關(guān)鍵發(fā)育事件。研究團(tuán)隊(duì)首先對(duì)類囊胚的誘導(dǎo)流程和相關(guān)參數(shù)進(jìn)行了系列改進(jìn),高效穩(wěn)定誘導(dǎo)猴干細(xì)胞類囊胚結(jié)構(gòu)。在此基礎(chǔ)之上,通過(guò)將原先的體外培養(yǎng)系統(tǒng)從2D培養(yǎng)改進(jìn)到3D懸浮培養(yǎng),發(fā)現(xiàn)干細(xì)胞來(lái)源的猴類囊胚可以高效、穩(wěn)健地發(fā)育至Day 17早期原腸期胚胎(從之前的4%提升到40%左右),這為進(jìn)一步開(kāi)展胚胎培養(yǎng)并改進(jìn)培養(yǎng)參數(shù)提供了可能。該體系能夠連續(xù)模擬靈長(zhǎng)類囊胚早期著床后(D11)到早期原腸胚階段(D17)的胚胎動(dòng)態(tài)發(fā)育過(guò)程,形成由上胚層(Epiblast)、羊膜腔(Amnion cavity)和卵黃囊腔 (Yolk sac cavity)構(gòu)成的靈長(zhǎng)類早期原腸胚階段典型雙層胚盤樣結(jié)構(gòu)。
研究團(tuán)隊(duì)測(cè)試了不同培養(yǎng)條件促進(jìn)Day17猴干細(xì)胞類胚胎進(jìn)一步發(fā)育的效果,發(fā)現(xiàn)在特定時(shí)間加入梯度濃度胎牛血清可以促進(jìn)胚盤進(jìn)一步發(fā)育至Day25,同時(shí)保持胚盤結(jié)構(gòu)的清晰和持續(xù)發(fā)育,包括Day20時(shí)期的顯著的胚盤拉長(zhǎng)和Day23時(shí)期的胚盤彎曲等典型的形態(tài)變化過(guò)程(圖1a-c),類似天然胚胎的卡內(nèi)基第8-9階段(CS8-9),即原腸運(yùn)動(dòng)的晚期及早期器官發(fā)生的起點(diǎn)。通過(guò)進(jìn)一步的組織形態(tài)學(xué)和單細(xì)胞轉(zhuǎn)錄組特征鑒定,這些體外培養(yǎng)的“猴類胚胎”在形態(tài)和細(xì)胞組成上,與相應(yīng)發(fā)育階段的天然猴胚胎高度相似(圖1d)。它們不僅能模擬靈長(zhǎng)類早期原腸胚期間前后軸、原條、羊膜腔和卵黃囊腔等典型結(jié)構(gòu)的形態(tài)發(fā)生,更重現(xiàn)了原腸運(yùn)動(dòng)后期的多個(gè)關(guān)鍵發(fā)育事件,包括神經(jīng)板(Neural plate, NP)的形成和早期神經(jīng)褶樣結(jié)構(gòu)(Neural groove, NG)的出現(xiàn)(圖1e-f),揭示了靈長(zhǎng)類大腦和神經(jīng)系統(tǒng)發(fā)育的最初“藍(lán)圖”;新生中胚層(Nas.Meso)、側(cè)板中胚層(Lateral plate mesoderm)以及心臟中胚層(Cardi.Meso)等高級(jí)中胚層譜系的分化和早期卵黃囊造血系統(tǒng)的發(fā)育。猴類胚胎在卵黃囊樣結(jié)構(gòu)中啟動(dòng)了原始造血,產(chǎn)生了包括內(nèi)皮細(xì)胞、造血祖細(xì)胞以及紅細(xì)胞在內(nèi)的多種血液細(xì)胞;定型內(nèi)胚層(Definitive endoderm, DE)的分化,形成了前腸 (Foregut)和后腸 (Hindgut) 的原始結(jié)構(gòu),以及尿囊等,為消化、呼吸等多種器官的發(fā)育奠定了基礎(chǔ);成功特化了原始生殖樣細(xì)胞(Primordial germ cell-like cells, PGCLCs),并追蹤了其從羊膜向胚胎后部遷移的路徑,高度模擬靈長(zhǎng)類PGC細(xì)胞體內(nèi)動(dòng)態(tài)發(fā)育的過(guò)程。全面的單細(xì)胞轉(zhuǎn)錄組測(cè)序分析證實(shí),這些類胚胎內(nèi)部的細(xì)胞類型、基因表達(dá)譜以及細(xì)胞分化路徑,與同期的自然胚胎高度吻合(圖1g-h),從分子層面證明了該模型的可靠性。
為進(jìn)一步驗(yàn)證該模型的實(shí)用性和可靠性,研究團(tuán)隊(duì)利用CRISPR/Cas9基因編輯技術(shù),構(gòu)建了TBXT和EOMES基因敲除的猴類胚胎模型。這兩個(gè)基因是啟動(dòng)原腸運(yùn)動(dòng)的關(guān)鍵調(diào)控因子。研究人員發(fā)現(xiàn)TBXT敲除導(dǎo)致類胚胎的胚盤縮短、體軸發(fā)育紊亂,中胚層和內(nèi)胚層分化嚴(yán)重受損,這與其在小鼠中的功能保守,并首次在靈長(zhǎng)類模型中揭示了其作用機(jī)制。EOMES敲除則嚴(yán)重影響了類囊胚的形成,揭示了說(shuō)明其在靈長(zhǎng)類滋養(yǎng)層發(fā)育中的發(fā)揮關(guān)鍵作用。基于猴類胚胎模型構(gòu)建的CRISPR基因擾動(dòng)系統(tǒng),突破了傳統(tǒng)模式生物研究的局限性,為體外系統(tǒng)性地解析靈長(zhǎng)類胚胎發(fā)育尤其是原腸運(yùn)動(dòng)時(shí)期的關(guān)鍵調(diào)控基因和譜系分化規(guī)律提供了重要研究平臺(tái)范式。
該工作創(chuàng)建了首個(gè)在體外完整模擬靈長(zhǎng)類原腸運(yùn)動(dòng)至早期器官發(fā)生的干細(xì)胞類胚胎模型,它涵蓋了從囊胚到原腸運(yùn)動(dòng)完成中的的多個(gè)重要事件。未來(lái),該模型可以直觀地“看到”靈長(zhǎng)類生命早期構(gòu)建的過(guò)程,并深入解析其譜系發(fā)生規(guī)律和背后的調(diào)控機(jī)制,此外,也提供了一個(gè)可以進(jìn)行遺傳操作和高效篩選的強(qiáng)大工具,用以研究發(fā)育疾病的根源并進(jìn)行相關(guān)藥物的胚胎安全性測(cè)試。文章在線后,同期Nature以“靈長(zhǎng)類胚胎模型的一次飛躍”為題發(fā)表對(duì)研究的評(píng)論文章,指出該模型高度復(fù)刻了靈長(zhǎng)類胚胎前三周的關(guān)鍵發(fā)育事件,首次提供了一個(gè)能連續(xù)觀察受孕后大約6到22天的早期靈長(zhǎng)類發(fā)育過(guò)程的胚胎模型,使得體外按順序分析靈長(zhǎng)類早期胚胎發(fā)生的動(dòng)態(tài)復(fù)雜過(guò)程成為可能。
腦智卓越中心/上海腦科學(xué)與類腦研究中心劉真研究員、腦智卓越中心李杰副研究員、孫強(qiáng)研究員,西班牙龐培法布拉大學(xué)Alfonso Martinez-Arias教授和西北農(nóng)林科技大學(xué)王小龍教授為該論文共同通訊作者。腦智卓越中心副研究員李杰(女)、博士后李杰(男)、博士生曹靜(與西北農(nóng)林科技大學(xué)聯(lián)合培養(yǎng))、尚申申(與上海科技大學(xué)和臨港實(shí)驗(yàn)室聯(lián)合培養(yǎng))為該論文共同第一作者。腦智卓越中心張連升博士、研究生高菲、傅吉強(qiáng)博士、陳紅玉博士、光原創(chuàng)新科技有限公司吳昊源、廣州實(shí)驗(yàn)室崔桂忠研究員等為本研究提供了重要幫助。本研究得到了國(guó)家自然科學(xué)基金委、中國(guó)科學(xué)院、科技部和上海尚思自然科學(xué)研究院的資助。
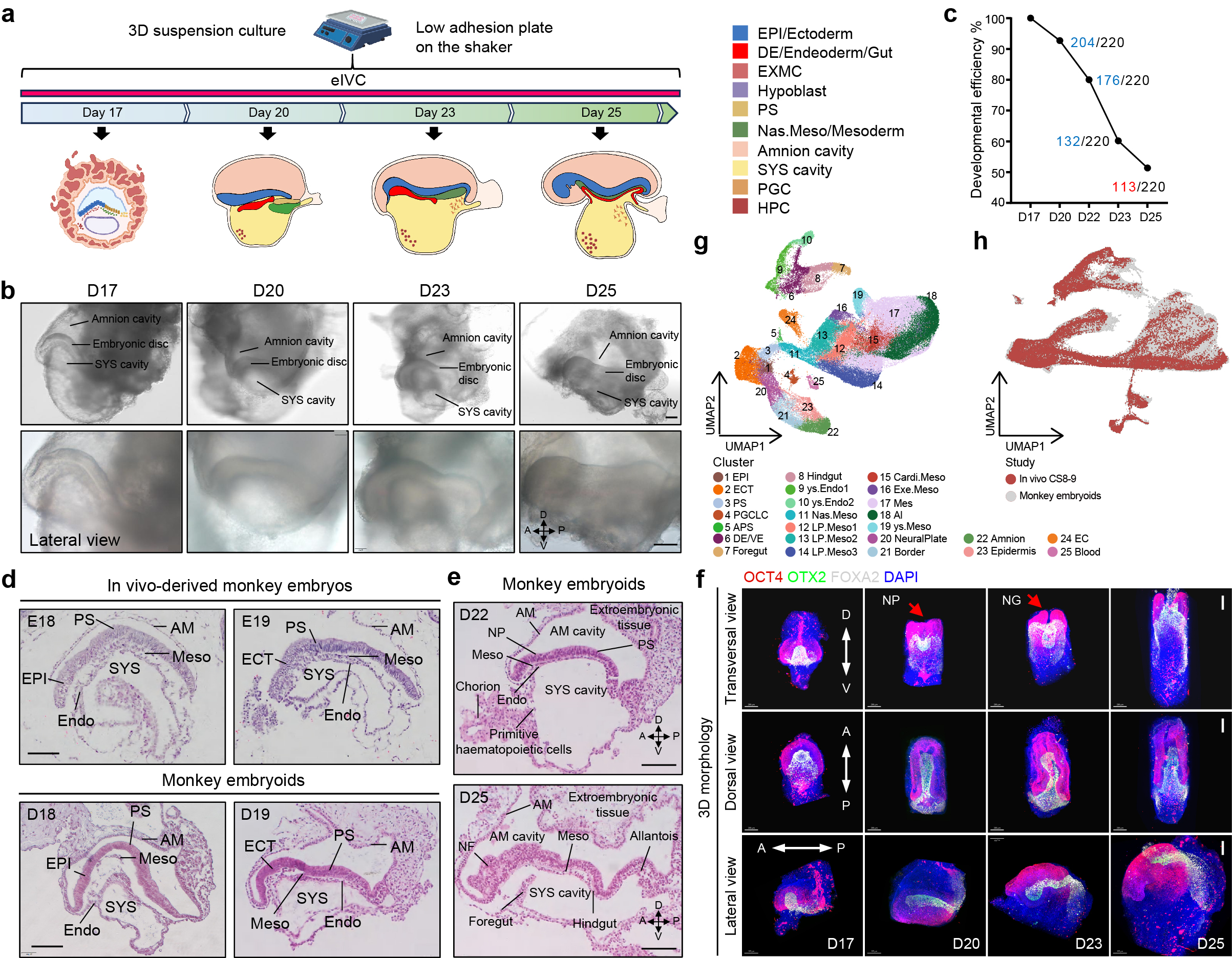
圖1. (a) 猴類胚胎發(fā)育至第25天(D25)的三維懸浮培養(yǎng)系統(tǒng)示意圖。(b) D17至D25猴類胚胎明場(chǎng)圖。(c) D17至D25期間猴類胚胎發(fā)育效率統(tǒng)計(jì)。(d) E18和E19階段天然猴胚胎(上)及D18、D19猴類胚胎(下)的對(duì)比。(e) 猴類胚胎在第22天(D22)和第25天(D25)的H&E染色圖像。(f) D17-D25階段猴類胚胎的3D重構(gòu)圖。(g) UMAP展示猴類胚胎所有細(xì)胞類型的分布。(h)猴類胚胎與CS8-9階段天然猴胚胎的單細(xì)胞整合分析。
 附件下載:
附件下載: